Patch-clamp manual
El patch-clamp manual (MPC) fue desarrollado por Erwin Neher y Bert Sackman en 1976 por lo que fueron galardonados con el premio Nobel el 1991. MPC es una herramienta versátil que permite la grabación de eventos electrónicos a nivel celular y que revolucionó nuestros conocimientos cardíacos y neurofisiológicos.
Tanto cultivos celulares como tejido ex vivo se pueden preparar en una cámara de cultivo unida a un microscopio, lo cual permite la visualización de las células de interés. Los microelectrodos de vidrio están en contacto con las membranas celulares y la aplicación de succión permite la formación de un cerrado hermético. Las señales eléctricas se pueden sumar y grabar de forma “cell-attached” o “whole-cell” (Figura 1). De forma alternativa, se pueden aislar porciones de membrana para grabar señales eléctricas producidas por un único canal iónico (configuraciones “outside” o “inside-out).


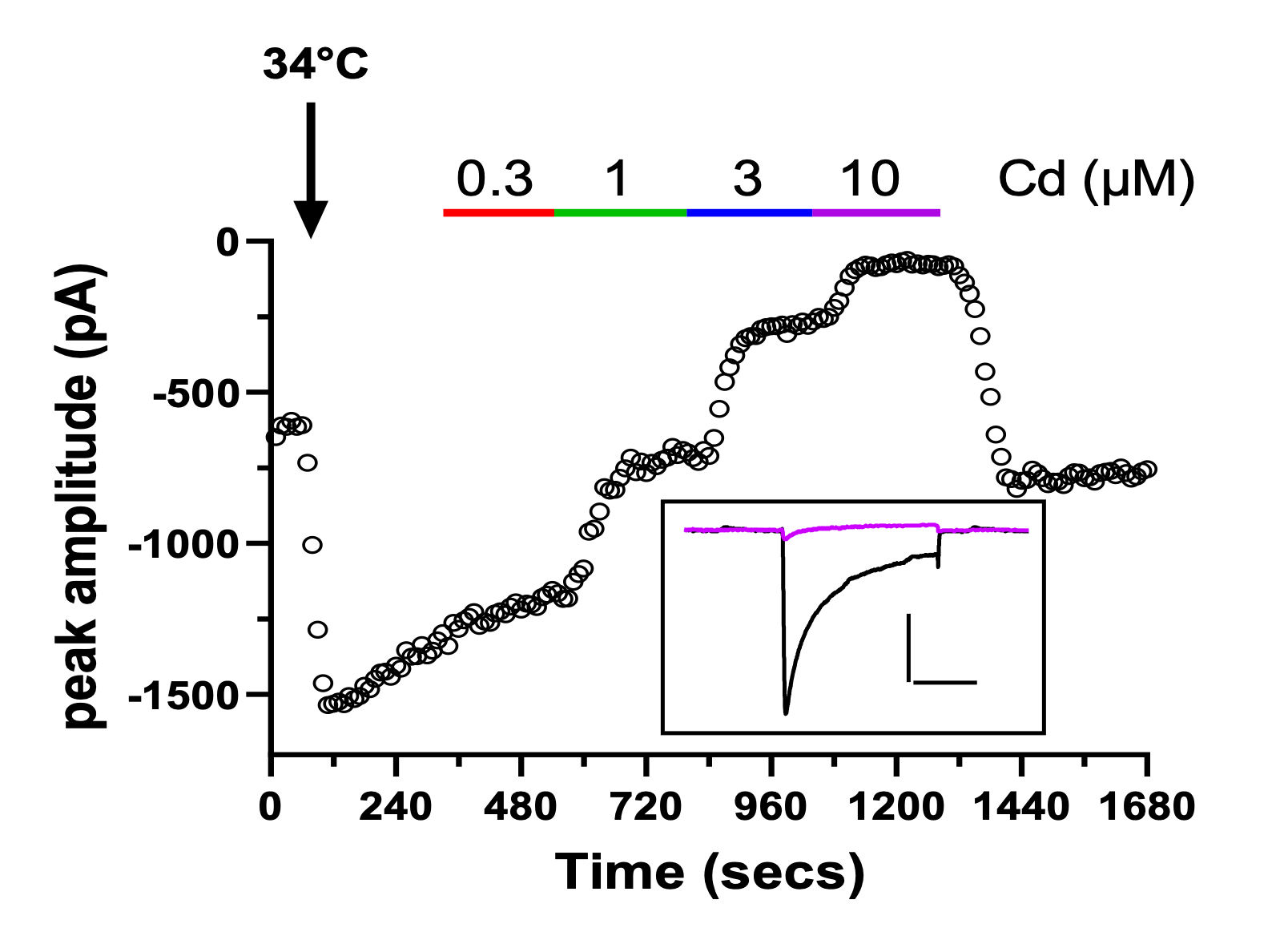
Figura 1 – Ejemplo de grafica temporal con las trazas correspondientes de las grabaciones de células que expresan canales hERG (A, escala 500pA, 500ms) o CaV2.2 (B, escala 500pA, 20ms).
Un inconveniente de MPC es que su bajo rendimiento es incompatible con el cribaje de muchos compuestos farmacológicos de forma rápida. De modo que máquinas patch-clamp automatizadas (APC) fueron desarrolladas y, desde entonces, han prácticamente reemplazado los MPC como técnica de cribaje de canales iónicos más usada. A pesar de eso, las ventajas de los MPC son, por ejemplo:
– El estudio de fenotipos de transgenes fluorescentes (Figura 2)
– Grabaciones de canales iónicos.
– Estudios GLP
– Desarrollo de ensayos
– Evaluación de acciones intracelulares de compuestos de bajo volumen.
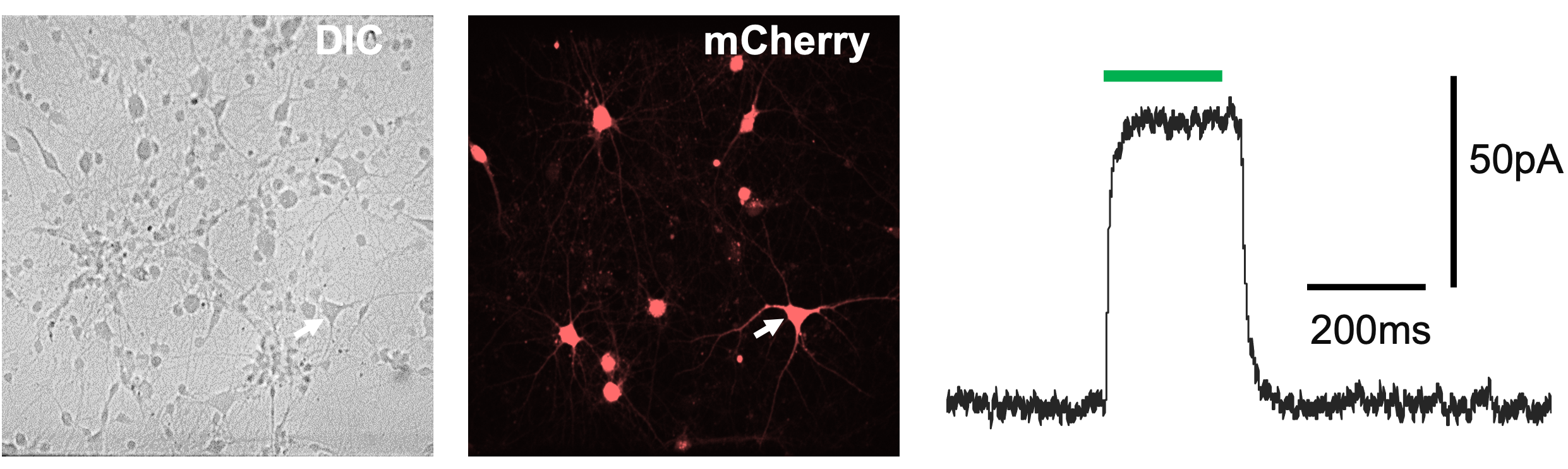
Figura 2 – Grabación de MPC en una célula entera fluorescente (indicada con una flecha blanca)
ApconiX ofrece tanto MPC como APC para estudios personalizados adaptados a las necesidades del cliente.
Mediciones de recuperación tras el bloqueo de canales de sodio activados por voltaje y clasificación Vaughan-Williams
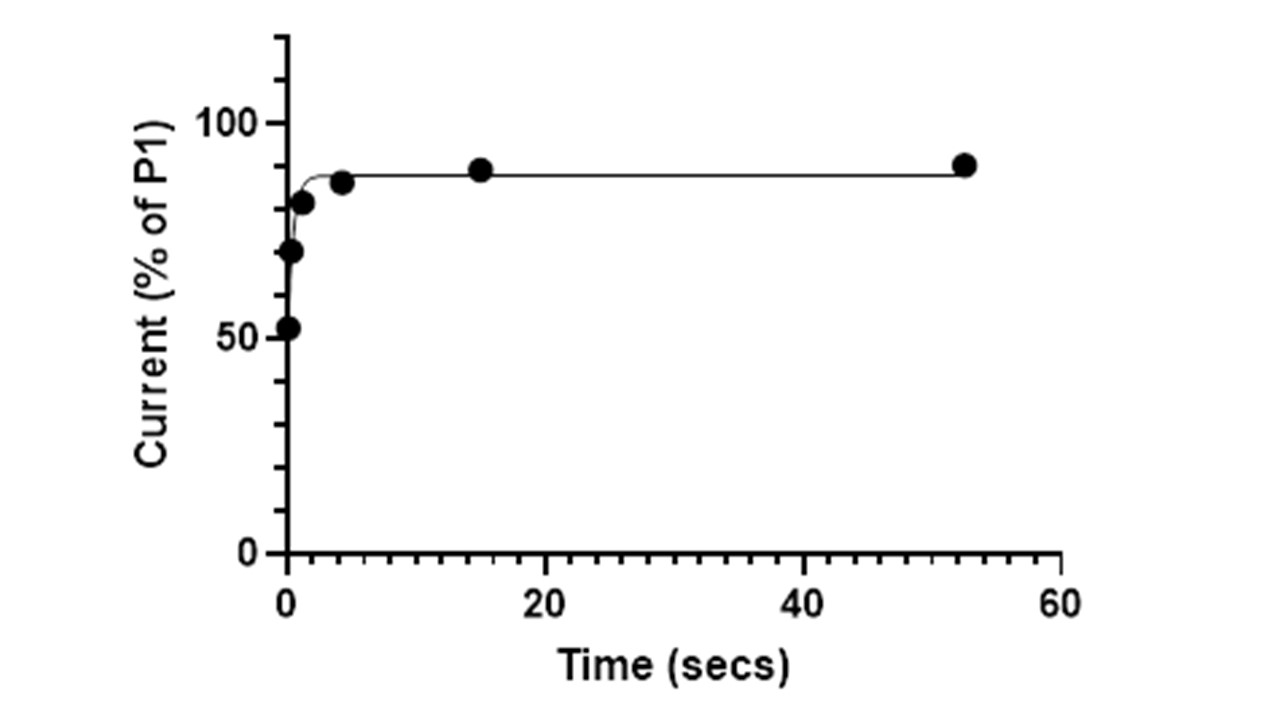
Gráfico que representa la recuperación de un canal de sodio tras su inhibición, 30uM mexiletina.
El estudio de arritmias cardíacas es esencial para el desarrollo farmacológico. Décadas de trabajo han contribuido al conocimiento del papel del canal de potasio hERG en la prolongación de la onda QT, y las estrategias han evolucionado para la identificación y reducción de riesgos a través de “lead optimisation” (Pollard et al., 2018). Más recientemente, el paradigma CiPA ha permitido la expansión del campo a un panel más grande de canales iónicos cardíacos junto con modelos in silico y estudios con cardiomiocitos para definir los riesgos de arritmia (Gintant et al., 2016).
Además, la FDA muestra un interés creciente por las consecuencias funcionales de la inhibición de canales de sodio cardíacos. De modo que ahora pide estudios de caracterización de recuperación tras inhibición y clasifica los fármacos según el esquema Vaughan-Williams (Lei et al., 2018).
En nuestro laboratorio podemos medir la recuperación de inhibición con patch-clamp automático. La muestra se compara con quinidina, mexiletina y flecainida, que se caracterizan por una recuperación rápida, mediana y lenta respectivamente.
Los experimentos se llevan a cabo a temperaturas casi fisiológicas. Estos estudios no son GLP pero pueden ser usados para entregas reglamentarias.

Sostenibilidad en ApconiX
Como empresa consciente con el medio ambiente, siempre buscamos formas de integrar practicas sostenibles como parte del día a día en el laboratorio y de reducir desperdicios plásticos. Cada año, los productos y equipamiento requeridos para cultivos celulares generan toneladas de desperdicios plásticos que no pueden ser reusados ni reciclados. Hace tiempo que esto supone un problema de impacto medioambiental ya que los plásticos son mandados a vertederos además de incrementar los costes de trabajo en el laboratorio. Nuestros estudios de cribaje de canales iónicos requieren el uso de plásticos de un solo uso, lo que supone un coste financiero y medioambiental que contribuye a nuestra huella de carbono.
Se estima que hasta el 2022, nuestro departamento de cultivos celulares generaba una media de 80Kg de desperdicios plásticos cada mes. Además, la mayoría de plantas de reciclaje no aceptan plásticos provenientes de laboratorios biológicos por riesgos de contaminación.
Durante la primera mitad del 2022, realizamos un estudio para la generación de líneas celulares listas para ensayos en lugar de cultivos celulares continuos, lo que supuso un ahorro de tiempo y una reducción de desperdicios plásticos en comparación con los métodos de cultivo celular tradicionales. Se trata de células congeladas a altos niveles de viabilidad, aptas para cribajes de seguridad de fármacos y que pueden ser usadas en ensayos patch-clamp directamente después de ser descongeladas sin necesidad de cultivo o “passage”. Estas células muestran niveles de viabilidad excelente y actividad funcional comparable con cultivos celulares tradicionales en ensayos de dosis-respuesta.

Reducción del uso de suero fetal bovino en cultivos celulares
El suero fetal bovino (FBS) es la fracción liquida de la sangre de fetos bovinos. Se usa comúnmente como suplemento en cultivos celulares ya que contiene millares de componentes que facilitan la adhesión, el crecimiento y manutención celular. Sim embargo, su composición no está bien definida, lo que puede comportar varios problemas científicos. Por ejemplo, la composición puede variar entre lotes e incrementar la variabilidad experimental o puede contener factores adversos y crear problemas de bioseguridad. También existen preocupaciones éticas alrededor de la práctica de recolección de FBS, ya que expone al feto a dolor. Desde un punto de vista financiero, la demanda y suministro inestable de FBS han supuesto un incremento de 300% del precio en los últimos años. De modo que el uso de una alternativa sintética definida químicamente sería favorable científica, ética y financiablemente, aunque aún no se ha desarrollado una alternative de eficacia comparable. Estos experimentos pretenden adaptar nuestras líneas celulares a bajas concentraciones de suero mediante el uso de suplementos comerciales para su cultivo.
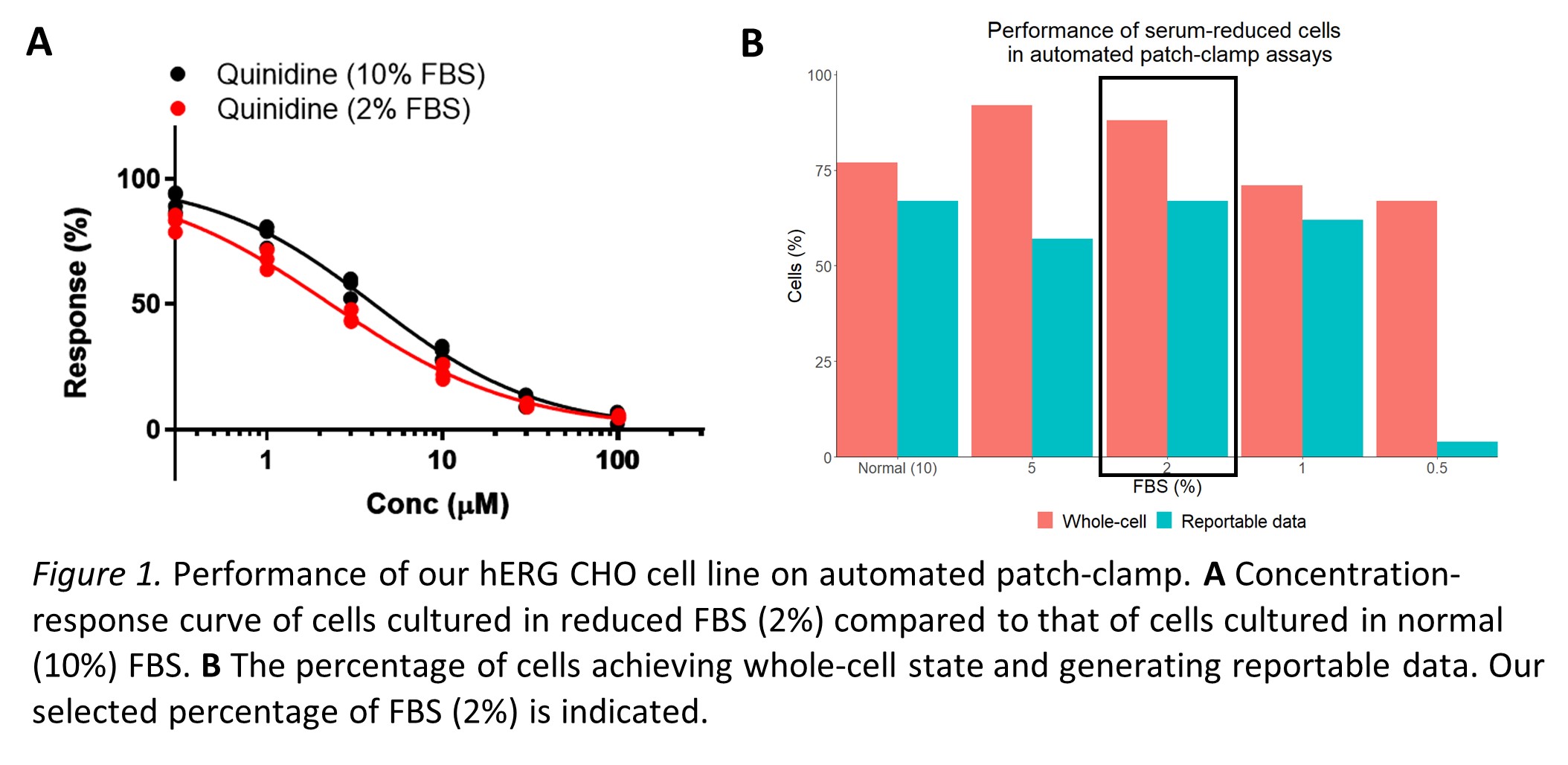
La reducción de FBS fue investigada usando nuestra línea celular hERG CHO. Estas células se cultivaron con distintos porcentajes de FBS y su actividad fue medida vía patch-clamp automatizado (Figura 1). Concluimos que una reducción del 10% al 2% fue la adaptación con más éxito. El laboratorio continua sus esfuerzos para optimizar y validar la actividad celular, y así trabajar hacia un enfoque más ético y sostenible.

